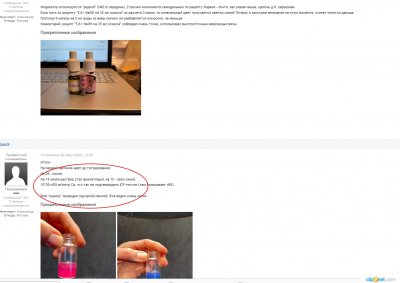
Добрый день.
Решил довести до конца исследование самых выдающихся аквариумистов-химиков нашего форума.
Суть следующая: для изготовления полноценного самодельного теста на Ca в морской воде нужны 3 компонента.
а) №1 - едкая щелочь (с ее помощью весь магний выводится в осадок, чтобы не мешать компоненту №3 проводить замеры исключительно по Ca)
б) №3 - раствор Трилона-Б (добавляя его по каплям связываем оставшийся Ca, подводя содержимое такового к 0, что заставляет индикатор №2 менять цвет, сигнализируя нам об этом )
в) №2 - индикатор, дающий резкий переход окраса раствора по завершении измерения.
Вот с №2 и возникает проблема.
За основу взял компоненты теста JBL на кальций ( на рисунке). Компоненты №1 и №3 удалось сделать самостоятельно вообще без проблем.
Что касается №2: перепробовал все индикаторы, которые нашел как в указанной ниже теме, так и в инете. Ни один из них не дает четкий резкий переход. Некоторые вообще никак не реагируют, хотя в трудах по титрированию Ca о них отзываются очень восторженно.
Все результаты опытов вместе с фотоматериалами выложил по ссылке:
Так же попробовал провести тест, существенно повысив щелочность в измеряемой жидкости - на результат это не повлияло.
JBL каким-то образом изготавливает порошок, дающий тот самый резкий переход цвета (описал там же). По цветам он очень напоминает мурексид.
Может быть у кого-то на форуме есть среди знакомых или родственников химики, которые могли бы указать на важные детали, касающиеся проведения титрирования?