Вы заблуждаетесь )
Т.е. вы утверждаете, что ионы хлора в растворе могут накапливаться до бесконечности?


Отправлено 15 Июнь 2015 - 22:05
Вы заблуждаетесь )
Т.е. вы утверждаете, что ионы хлора в растворе могут накапливаться до бесконечности?
Отправлено 15 Июнь 2015 - 22:07
Нет. Они с Na вступают в реакцию образуя хлорид натрия. Для этого и добавляют соль без соли, что бы получить баланс соли. Немного распреснить и получить стабильность ![]()
Отправлено 15 Июнь 2015 - 22:11
Нет. Они с Na вступают в реакцию образуя хлорид натрия. Для этого и добавляют соль без соли, что бы получить баланс соли. Немного распреснить и получить стабильность
Ваня, так свободных катионов натрия не добавлялось.... я соду не сыпал !!!
Отправлено 15 Июнь 2015 - 22:16
Т.е. вы утверждаете, что ионы хлора в растворе могут накапливаться до бесконечности?
Отправлено 15 Июнь 2015 - 22:36
Не так. Я утверждаю, что ионы хлора соединяться друг с другом с образованием свободного хлора, коий, кстати, яд, в растворе не будут. При потреблении катионов кальция всегда найдется механизм компенсации ионного баланса раствора.
Получается, если вода пресная, то хлор улетучивается, а если в воде присутствует NaCl, то включается некий тайный "механизм компенсации ионного баланса" ???
Отправлено 15 Июнь 2015 - 22:56
Получается, если вода пресная, то хлор улетучивается, а если в воде присутствует NaCl, то включается некий тайный "механизм компенсации ионного баланса" ???
Какую форму хлора Вы подразумеваете, когда касаетесь примера с пресной водой? Гидраты хлора, гипохлорит, хлорид? Механизмов компенсации ионного баланса "море в море с хвостиком" - вплоть от связывания ионов с образованием осадка или газа, растворения осадков, до включения ионов в кристаллическую решетку осаждаемого вещества. И не каждый химик однозначно Вам скажет о том, какой механизм работает в конкретном случае, ибо многое не изучено попросту.
Ну, а чтобы не мудрить с балансом морской воды и существует метод Баллинга, или КР+добавки. Подмены же помогают отчасти баланс поддержать.
Отправлено 15 Июнь 2015 - 23:27
Да, в дополнение. Ионы же в растворе не связаны строго друг с другом, например, гидрокарбонат строго с кальцием, точно также он может быть связан, скажем и с натрием, коего в морской воде более чем достаточно. И, например, если льёте в банку хлорид кальция, то можете считать, что в реакцию с хлоридом кальция вступит гидрокарбонат натрия. Да, и при добавлении только хлорида кальция, не факт, что кальций "скушали" кораллы, он мог попросту осадиться.
Отправлено 15 Июнь 2015 - 23:38
Да, в дополнение. Ионы же в растворе не связаны строго друг с другом, например, гидрокарбонат строго с кальцием, точно также он может быть связан, скажем и с натрием, коего в морской воде более чем достаточно. И, например, если льёте в банку хлорид кальция, то можете считать, что в реакцию с хлоридом кальция вступит гидрокарбонат натрия, в итоге понизится KH. Да, и при добавлении только хлорида кальция, не факт, что кальций "скушали" кораллы, он мог попросту осадиться.
Я считаю, что морская вода это набор ионов и катионов а не хлоридов, сульфатов, боридов, карбонатов и тд, и если число катионов/анионов не равно, то что-то выпадет в осадок или улетучится в виде газа, но их соотношение не нарушится, если, к примеру, добавлять только хлориды.
Отправлено 15 Июнь 2015 - 23:47
Правильно считаете.
Это радует ![]()
Тогда, если не добавлять Na+, который никем не потребляется, у нас не возникнет никаких дисбалансов ионов и излишков NaCl ?
Отправлено 16 Июнь 2015 - 00:18
Ищите в др. ответ, но не в выделении хлора за счет связывания его анионов. ![]() Так как данный процесс не возможен, если, конечно, это не электролиз морской воды на инертном аноде. )
Так как данный процесс не возможен, если, конечно, это не электролиз морской воды на инертном аноде. )
Отправлено 16 Июнь 2015 - 01:08
Это радует
Тогда, если не добавлять Na+, который никем не потребляется, у нас не возникнет никаких дисбалансов ионов и излишков NaCl ?
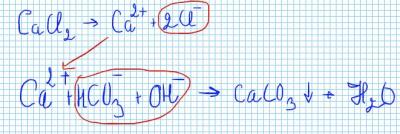
Отправлено 16 Июнь 2015 - 09:10
И будут они (2Cl-) ждать свою соду, что бы взять от туда натрий и повысить КН и соленость ))
Отправлено 16 Июнь 2015 - 10:57
Отправлено 16 Июнь 2015 - 10:59
Я вот что не понимаю, почему калий добавляется в виде хлорида калия, а не карбоната ?
Я добавлял и карбонатом, но он ОЧЕНЬ сильно поднимает pH.
Отправлено 16 Июнь 2015 - 11:11
Я вот что не понимаю, почему калий добавляется в виде хлорида калия, а не карбоната ?
Отправлено 16 Июнь 2015 - 13:46
Карен, ты прекрасно понимаешь что в этом случае с калием мы добавляем хлорид ион, которых и так уже в переизбытке ...Потому что мы хотим дозировать калий, а не КН.
Отправлено 16 Июнь 2015 - 14:45
В водных растворах электролитов один ион может "сцепиться" с другим только ради одной цели - вместе выпасть в осадок.Хлорид ион с натрием точно сцепится.
0 пользователей, 1 гостей, 0 анонимных