Продолжим. Сначала по делу, а потом, может быть, отвечу по мотивам постов которые были выше.
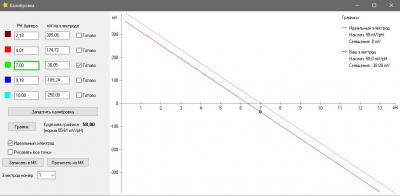
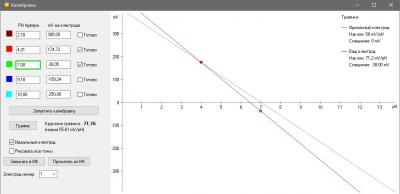
Калибровка.
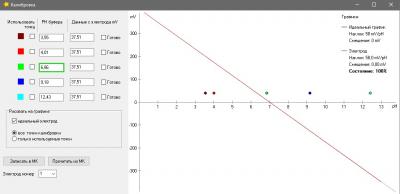
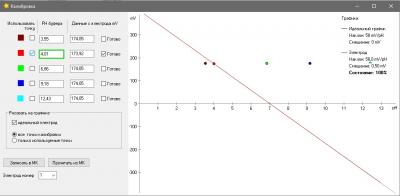
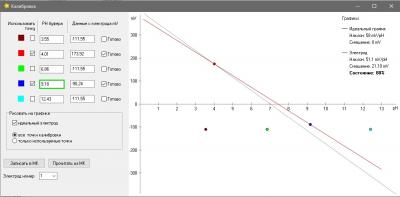
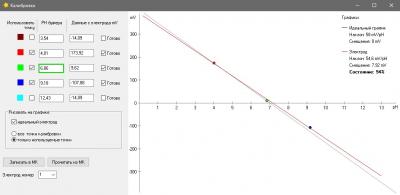
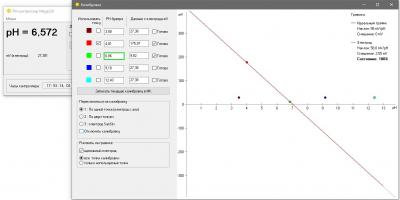
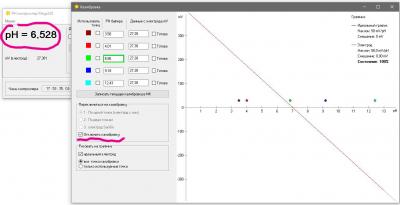
Одна из вещей, которая бесила меня страшно в моем фирменном pH метре был процесс калибровки. Сначала в меню выбрать набор стандартных калибровочных растворов (а они разные в США и в Китае - циферки отличаются). Понятно, что это одноразовая процедура при базовой настройке прибора, но, блин, я был не в состоянии запомнить и каждый раз у меня было сомнение, под какой стандарт попадают мои растворы, под китайский или американский и где в глубинах меню это можно посмотреть (нажав 100500 раз на кнопочки). Это первое. А второе - автоопределение растворов. Я кладу электрод в банку с раствором pH 7, прибор радостно сообщает, что точка pH 9.13 откалибрована. Да чтоб ты сдох, это буфер 7, а не 9 ! Я сменил два недешевых электрода, так как думал что мои настолько испорчены, что вместо 7 показывают 9... но оказалось что что-то испортилось в самом приборе. Если бы был нормальный, человеческий процесс калибровки, то идентифицировать эту проблему было бы просто. А так потеряны деньги. На этом предисловие закончено.
Теория.
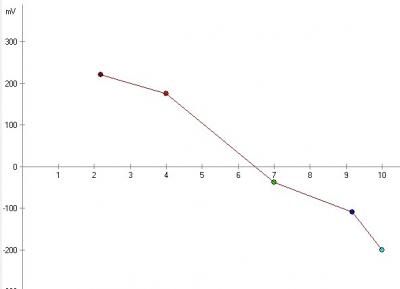
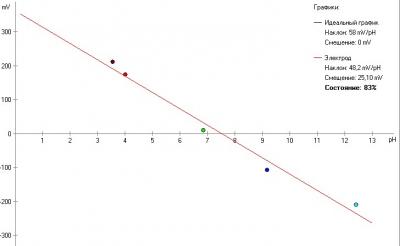
pH электрод это батарейка с напряжением зависящим от pH. В теории (есть такое уравнение Нернста) электрод должен выдавать 59 mV (милливольт) на единицу pH, причем зависимость строго линейна (график - прямая линия). При pH 7.0 идеальный электрод должен выдавать 0 вольт. В кислой среде выдает плюс, в щелочной - минус. График зависимости напряжения от pH для идеального электрода выглядит так:
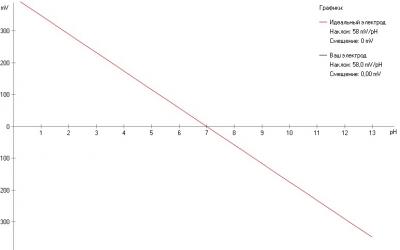
Как показала практика, даже самый отстойный китайский электрод с али, хотя и отклоняется от теоретического графика, но прям не так уж и сильно, не в разы. А на дешевых приборах я видел очень большие ошибки в показаниях. Отчего так? Может и ошибаюсь, но по ощущениям это наложение невнятной схемотехники на погрешности самого электрода.
Возьмем самый популярный pH модуль для подключения к Ардуино, вот такой,

смотрим схему. И видим, что напряжение на выходе нам предлагают отрегулировать измерением мультиметром и кручением потенциометра. Далее подключаем к АЦП, макаем электрод в первый калибровочный раствор, получаем цифру с АЦП (причем цифру в абстрактных попугаях, не в милливольтах), макаем во второй раствор, смотрим разницу, после чего вычисляем сколько единиц pH приходится на один абстрактный попугай с АЦП. Понятны мои рассуждения, или надо помедленнее? Еще раз - вы стразу привязываетесь к двум калибровочным растворам и к данному положению потенциометра, НИЧЕГО при этом не зная о том, насколько близки или далеки эти цифры от теоретически ожидаемых. (Я уж не говорю о том, что клоуны, которые его делали, расположили термодатчик, который в теории должен быть либо в электроде либо в растворе отдельно, расположили на самой плате - он не мешает, можно не использовать, точнее нельзя использовать, просто как иллюстрация грамотности и культуры тех, кто эти платки разрабатывал и клепает).
А чем отличается довольно таки простая схема от Analog Devices, которая лежит в основе описываемого здесь прибора? Тем, что электроника в ней откалибрована аппаратно просто исходя из схемотехники - pH7 строго стоит на нуле (не надо крутить потенциометр - вы все равно точно не выставите и не измерите своим мультиметром). То есть, на выходе, сразу из коробки, без калибровки, мы получаем не абстрактные цифры (которые потом привязываем к данному электроду и данным буферным растворам), а получаем точные и однозначные данные - милливольты. По которым - внимание - можем рассчитать pH даже вообще без калибровки электрода. Ошибка будет конечно, в зависимости от паршивости электрода, но в районе и вокруг pH 7 будет не такая уж и большая.
Понятно, что без калибровки - это не наш метод, но во всяком случае ошибки электроники у нас нет совсем, и калибровки наша электроника не требует.
Это была теория, про практику напишу чуть позже.